
Рак лімфатичних вузлів
ХВОРОБА ГОДЖКІНА. НЕГОДЖКІНСЬКІ ЛІМФОМИ
Хвороба Годжкіна (ХГ) або лімфогранулематоз і негоджкінські лімфоми (НГЛ) належать до злоякісних лімфом, або системних злоякісних пухлин лимфоїдної і кровотворної тканин з переважним ураженням лімфатичних вузлів (ЛУ).
Відповідно до гістологічної класифікації пухлинних захворювань кровотворної і лимфоїдної тканин, прийнятої ВООЗ у 1976 році, серед пухлин виділяють:
а) лімфосаркому;
б) грибовидний мікоз;
в) плазмоцитому;
г) ретикулосаркому;
д) некласифіковані злоякісні лімфоми;
е) хворобу Годжкіна (лімфогранулематоз);
є) інші: еозинофільна гранульома, мастоцитома.
Захворюваність на ХГ и НГЛ є неоднаковою у різних країнах світу. До регіонів з високим рівнем захворюваності на ХГ и НГЛ відносять ряд африканських країн, США, (штат Нью-Йорк – 13,7 на 100 тис. населення, Гаваї – 10,8 на 100 тис.), Японію (Нагасакі – 13,9 на 100 тис. населення).
У Нігерії гемобластози в структурі злоякісних новоутворень посідають перше місце, складаючи 25% усіх онкологічних захворювань дорослих і дітей.
В Україні захворюваність на ХГ у 2015 році дорівнювала 2,6 на 100 тис. населення, а на злоякісні лімфоми – 4 на 100 тис., а смертність – 0,5 та 1,9 на 100 тис. населення відповідно.
ХГ може виникнути у будь-якому віці; класичний розподіл за віком має два піки цього захворювання: перший у віці 20–30 років, другий – у 60 років і більше. За винятком дітей молодше 10 років, серед яких захворюють на ХГ переважно хлопчики, до двох піків за віком розподіл за віком стає практично однаковим. ХГ у дітей складає в середньому 10–15% усіх хворих на ХГ. У США понад 90% хворих на ХГ – люди білої раси.
У зв’язку зі специфікою клінічної картини захворювання, більшість дослідників відносили ХГ до захворювань інфекційного походження. Роль збудника ХГ помилково відводилась туберкульозній мікобактерії, дифтероїдним бацилам, грибкам, кишковій паличці, блідій спірохеті, стрептококам тощо.
Однак проти інфекційної природи ХГ свідчить:
- Неефективність антибактеріальної терапії.
- Спорадичність виникнення захворювання; не помічено його ендемічного розповсюдження.
- Не відомі випадки захворювання внаслідок зараження від хворої людини, хоча хворі протягом тривалого часу перебувають у близькому контакті зі своїми родичами, а під час госпіталізації – з обслуговуючим персоналом.
В останні десятиріччя склалось чітке уявлення про безперечну належність ХГ до злоякісних пухлин.
Патогенез ХГ полягає у пригніченні клітинного імунітету: порушенні функції Т-лімфоцитів. Захворювання починається уніцентрично в одній з лімфатичних структур: лімфатичних вузлах, селезінці, тимусі, кільці Вальдейера-Пирогова тощо. Далі здійснюється, як правило, послідовне метастазування, переважно лімфогенним шляхом. У пізніх стадіях при ураженні селезінки, інвазії судин, можливе гематогенне метастазування з наступним розвитком метастазів у печінці, кістках, легенях і т.п.
Згідно Міжнародної класифікації пухлин (ВООЗ, 2008), хворобу Годжкіна поділяють на чотири гістологічних варіанти (Lukes, Batler: Класифікація Rye):
- Лімфогістіоцитарний, або лимфоїдної переваги/
- Нодулярний склероз.
- Змішано-клітинний.
- Лімфоїдне виснаження, ретикулярний варіант, або дифузний склероз.
При лімфогістіоцитарному варіанті ХГ рідко визначаються клітини БРШ, мають перевагу лімфоїдна і гістіоцитарна проліферація; при нодулярному склерозі лімфатичні вузли поділені на окремі ділянки грубоволокнистої кільцеподібною тканиною, виявляються клітини БРШ. При змішаноклітинному варіанті спостерігають багато клітин БРШ, вогнища некрозу, строкатий клітинний склад (лімфоїдні та плазматичні клітини, фібробласти, гістіоцити, еозинофільні й нейтрофільні лейкоцити, клітини ендотелію судин). При лімфоїдному виснаженні різко зменшується кількість лімфоцитів та інших клітин, розвивається сполучна тканина. Перші два варіанти ХГ характеризуються сприятливим прогнозом, два останніх – несприятливим. Морфологічні варіанти ХГ не є стабільними. З прогресуванням захворювання відбувається еволюціонування від лімфогістіоцитарного варіанту до лімфоїдного виснаження .
Лімфосаркома, або НГЛ, як правило, має В-клітинне походження (до 85 %). Нині початкову стадію НГЛ прийнято розглядати як локальний процес, що з розвитком захворювання перетворюється у генералізований, з ураженням всіх органів і тканин. Згідно Міжнародній гістологічній класифікації пухлин лимфоїдноі та кровотворної тканин (ВООЗ, 2008), лімфосаркоми поділяються на нодулярні й дифузні, серед яких, в свою чергу, виділяють шість морфологічних типів:
- лімфоцитарна;
- лімфоплазмоцитарна;
- пролімфоцитарна;
- лімфобластна;
- імунобластна;
- лімфосаркома Беркіта.
Високозлоякісними, несприятливими за клінікою і прогнозом, вважаються три останніх типи НГЛ.
У 1982 році у США запропоноване так зване Робоче Формулювання (РФ) (Working Formulation) класифікації НГЛ. У РФ всі НГЛ розділені на три великі категорії: низького, проміжнього й високого ступеня злоякісності. Однак, численні клініцисти вважають, що принципово існують дві категорії НГЛ: лімфоми з тривалим перебігом, що у більшості випадків невиліковні, й лімфоми з агресивним перебігом, при яких можливо вилікувати хворого. Першій категорії відповідають лімфоми низького й проміжного ступенів злоякісності за РФ, а другій – високозлоякісні лімфоми.
Нині практично ще не прийнято рішення про застосування класифікації ТNМ при злоякісних лімфомах. З 1971 року використовується стадуюча класифікація Анн Арбор, в якій враховуються як клінічна, так і біологічна стадія ХГ. При цьому встановлено, що прогноз захворювання не погіршується, якщо крім ураження лімфатичних вузлів є локалізоване екстралімфатичне розповсюдження хвороби; виконання лапаротомії зі спленектомією дозволяє уточнити ступінь розповсюдження хвороби. Зараз існують дві системи класифікування: клінічна (сS) і патологічна (рS).
Стадуюча класифікація ХГ, прийнята в Анн Арбор у 1971 році
| Cтадія | Ознаки |
І | Ураження однієї лімфатичної зони (І) або локалізоване ураження одного нелімфоїдного органу або тканини (Іе) |
ІІ | Ураження двох і більше ділянок лімфовузлів з одного боку діафрагми (ІІ) або локалізоване ураження одного екстралімфатичного органу або тканини та їх реГіонарних лімфовузлів (и) з або без ураження інших лімфатичних ділянок з того ж боку діафрагми (ІІе). Примітка: кількість уражених лімфатичних ділянок може позначатись таким чином (ІІ 3). |
ІІІ | Ураження лімфовузлів з обох боків діафрагми (ІІІ), що може поєднуватись з локалізованим ураженням одного екстралімфатичного органу або тканини (ІІІе), або з ураженням селезінки (ІІІs), або ураженням того й іншого (ІІІе+s). |
ІV | Дифузне або дисеміноване (багатофокусне) ураження одного або декількох нелімфоїдних органів з поєднаним ураженням лімфовузлів або без нього |
Симптоми А і Б
Кожна стадія має бути поділена на А та Б, у залежності від відсутності (А) або наявності (Б) загальних симптомів. Серед них:
- Непояснена втрата ваги більш ніж на 10% за останні 6 місяців до звернення до лікаря.
- Непояснені підвищення температури понад 38,0ºС протягом 3-х діб.
- Профузна нічна пітливість.
Примітка: наявності одного тільки свербіння шкіри недостатньо для встановлення групи Б, так само як і тимчасових гарячкових станів, пов’язаних з невідомою інфекцією.
Виділяють також лабораторні ознаки активності ХГ:
- нейтрофільний лейкоцитоз;
- прискорення ШЗЕ;
- високий рівень фібриногену в крові;
- гіпер-α2- та гіпо-γ-глобулінемія.
Інтернаціональний прогностичний індекс
| Сприятливі прогностичні фактори | Несприятливі прогностичні фактори |
| До 60 років | Більше 60 років |
| І та ІІ стадії | ІІІ та IV стадії |
| Ураження тільки лімфатичних вузлів, або ураження однієї ділянки за межами лімфатичних вузлів | Лімфома більше ніж 1 органа за межами лімфатичних вузлів |
| Нормальна життедіяльність | Потреба у сторонній допомозі |
| Нормальний рівень ЛДГ у сировтці крові | Збільшений рівень ЛДГ у сировтці крові |
За кожен несприятливий прогностичний фактор хворий отримує 1 бал. Індекс розподілює пацієнтів на 4 прогностичні групи.
- Низьний ризик прогресування (0–1 прогностичний бал).
- Помірно низький ризик прогресування (2 бали).
- Помірно високий ризик прогресування (3 бали).
- Високий ризик прогресування (4–5 балів).
Згідно цих даних більше 75% хворих з низьким ризиком прогресування пережили 5-ти річний інтервал спостереження і тілько 30% пацієнтів пережили даний період маючи високий ризик прогресування.
Патологічна система стадіювання (рS)
При визначенні чотирьох стадій використовуються критерії, аналогічні тим, що застосовувались при клінічному стадіюванні, але додатково враховується інформація, отримана при лапаротомії. Спленектомія, біопсія печінки, лімфовузлів і кісткового мозку є обов’язковими при визначенні рS.
Стадіювання НГЛ відповідає системі Анн Арбор, запропонованій для хвороби Годжкіна.
У 1989 році міжнародний багатопрофільний комітет модифікував класифікацію Анн-Арбор. Ця модифікація, що має назву рекомендації Котсволд, робить значущими КТ та інші дослідження в оцінці розповсюдженості й обсягу пухлини.
Стадуюча класифікація КОТСВОЛД
| Cтадія | Ознаки |
| І | Втягування однієї ділянки лімфовузлів або однієї лімфоїдної структури (наприклад, селезінки, тимусу, вальдеєрова кільця) |
| ІІ | Втягування двох або більше ділянок лімфовузлів з одного боку діафрагми; середостіння – одна ділянка ураження, латерально обмежена ЛУ воріт легенів, кількість анатомічних ділянок має бути вказана цифрою ( наприклад, ІІ3) |
| ІІІ | Втягування лімфовузлів або лімфоїдних структур з обидвох боків від діафрагми ІІІ1; з ураженням воріт печінки й селезінки, целіакальних лімфовузлів або без нього ІІІ2; з ураженням парааортальних, клубових або мезентеріальних лімфовузлів. |
| ІV | Втягування екстранодальних ділянок (крім зазначених у пункті Е). |
Стадія А – безсимптомний перебіг хвороби;
Стадія В – захворювання супроводжується пропасницею, проливними потами, втратою ваги; х-масивне об’ємне ураження: більше однієї третини розширення, більше 10 см максимального розміру маси вузла;
Стадія Е – втягування поодинокої екстранодально ділянки за протяжністю або проксимально до відомої нодальної ділянки; CS – клінічна стадія; PS – патологічна стадія.
Яким є сучасний погляд на стадуючу лапаротомію? При лапаротомії окультні ураження при ХГ виявляють майже у 25% хворих, що за клінічними даними мають ураження, обмежене наддіафрагмальними ділянками. Однак загалом лапаротомій слід уникати, крім випадків, коли виявлені фактори значно змінюють варіант терапії.
Стадуюча лапаротомія показана хворим з I, II і III А стадією, яким як метод терапії планується опромінення. Якщо у значній кількості будуть виявлені лімфовузли у воротах селезінки (4 лімфовузла і більше) або парааортальні лімфовузли, то перевагу для таких хворих буде мати комбінована терапія.
Стадуюча лапаротомія не показана:
- Хворим з чітко верифікованою стадією III B або IV, яким планується проведення хіміотерапії.
- Хворим з великою пухлиною середостіння (1/3 діаметру грудної клітки), для яких перевагу має комбінована терапія.
- Хворим з ізольованим ураженням шийних лімфовузлів або тим, які не мають великого обсягу ураження середостіння з гістологічним варіантом “нодулярний склероз”. Цих хворих можна вести за допомогою тільки субтотального опромінення лімфовузлів.
ХГ часто проявляється збільшенням шийних лімфовузлів (75–80%) випадків (рис. 1). Лімфовузли можуть залишатись ізольованими або зливатись з сусідніми. Для НГЛ зрощення лімфовузлів у конгломерати є нехарактерним.
Першим проявом ХГ у підлітковому й молодому віці може бути велика пухлина середостіння. Так само можуть проявлятись НГЛ високого ступеня злоякісності.
На пізніших стадіях хвороби з’являються виражена загальна слабкість, хвильоподібна лихоманка, обмежене або генералізоване свербіння шкіри, профузна нічна пітливість, швидка втрата ваги. Свербіння шкіри майже не спостерігається у дітей, хворих на ХГ.
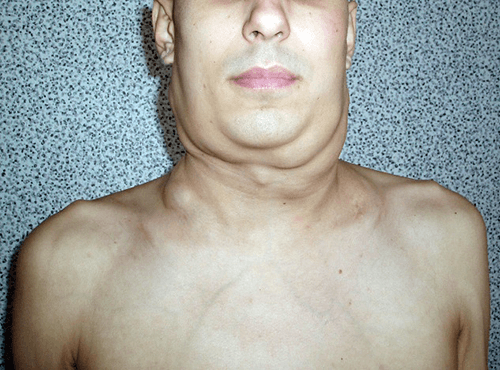
Рис. 1. Збільшення шийних лімфовузлів у хворого на ХГ
На відміну від ХГ, при НГЛ відсутні симптоми загальної інтоксикації, особливо на початкових стадіях, тоді як розповсюдженість процесу від самого початку є більш вираженою. Генералізація процесу настає рано. У 50% випадків хвороба починається з ураження лімфатичних вузлів, в решті – уражаються будь-які інші органи, що мають лімфоїдну тканину. Може уражатись шкіра, м’які тканини, травний тракт, печінка, мигдалики тощо. При ураженні кісткового мозку розвивається лейкемізація, що згодом переходить у гострий лейкоз.
Діагноз злоякісної лімфоми ставлять на основі клінічних, рентгенологічних і морфологічних даних. Вирішальними для постановки діагнозу й уточнення гістологічного варіанту є результати гістологічного та імуногістохімічного досліджень, або так званого імунофенотипування.
Протягом останніх років у США застосовується дослідження реаранжування генів імуноглобулінів і Т-клітинних рецепторів.
При фізикальному обстеженні слід звертати особливу увагу на всі ділянки розташування лімфовузлів, включаючи горло, шию, надключичні, пахвові, підколінні й пахвові ділянки, а також уважний огляд живота.
Радіографічні обстеження зазвичай включають рентгенографію грудної клітки, комп’ютерну томографію (КТ), позитронно-емісійну томографію (ПЕТ), органів черевної порожнини й тазу, а також додаткові, більш агресивні обстеження, необхідність яких продиктована симптомами. До них належать УЗД органів черевної порожнини, сканування кісток з радіонуклідами або рентгенографію кісток за наявності ознак їх ураження, КТ додаткових ділянок, наприклад, КТ грудної клітки при сумнівних результатах рентгенографії, сканування голови методом ядерно-магнітного резонансу (ЯМР) за наявності неврологічної симптоматики; лімфангіографія нижніх кінцівок, радіоізотопне обстеження лімфовузлів з галієм, технецієм. Важливу інформацію для стадіювання ХГ і НГЛ дає двобічна трепанобіопсія кісткового мозку (рис. 2).

Рис. 2. Рентгенограма і КТ хворого з ураженням лімфатичних вузлів середостіння
Лабораторні аналізи зазвичай включають повний аналіз крові з визначенням ШЗЕ, печінкових тестів, що оцінюють функцію печінки, печінкових ферментів, лужної фосфатази, протеїнограми.
Диференціальний діагноз при ХГ слід проводити зі специфічними лімфаденітами при таких інфекційних захворюваннях, як мононуклеоз інфекційний, бруцельоз, токсоплазмоз; саркоїдоз, НГЛ; реактивна гіперплазія лімфоїдної тканини різної етіології.
Для лікування ХГ використовують три варіанти терапії: опромінення, ПХТ і комбінацію опромінення й хіміотерапії.
Сучасні рекомендації щодо лікування ХГ:
- Стадія I A / II A – субтотальне опромінення лімфатичних вузлів.
- Стадія IB / IIB – комбінована терапія.
- Стадія IIIA / IIB – ПХТ. У хворих з мінімальним ураженням черевної порожнини, виявленим на лапаротомії, та стадією III А можна застосовувати субтотальне або тотальне опромінення лімфовузлів.
- Пухлина середостіння великої маси – комбінована терапія.
- Стадія IIIB / IV – ПХТ.
Променева терапія хворих на ХГ включає опромінення уражених ділянок і субтотальне або тотальне опромінення зон можливого метастазування.
Вибір ХТ для лікування ХГ має бути індивідуалізованим, відповідно стадії захворювання. До схем ХТ, що використовуються найбільш часто при ХГ, належать МОРР (ембіхін, онковін, прокарбазин, преднізолон), АВVД (адріаміцин, блеоміцин, вінбластин, дакарбазин).
Про вилікування хворого від ХГ можна говорити, якщо відсутність проявів захворювання спостерігається протягом 10 років і більше.
До найбільш значних факторів несприятливого прогнозу при ХГ відносять:
- обсяг пухлини;
- стадія процесу;
- наявність В-симптомів (зазвичай свідчить про великий обсяг пухлини);
- низький гематокрит і високий рівень лактатдегідрогенази;
- гістологічний тип пухлини.
Для лікування НХЛ використовують: хіміотерапію, імунотерапію, таргетну терапію, променеву терапія, трансплантацію кісткового мозку.
Основним видом лікування НГЛ є ПХТ, що у ряду випадків проводиться у поєднанні з опроміненням.
Загалом, у хворих НГЛ низького степеня злоякісності медіана виживаності складає 6 років. Ці відомості підкреслюють той факт, що, хоча більшість низькозлоякісних лімфом і відповідають на ХТ, остання має паліативний характер і не може вилікувати хворого від лімфоми на тривалий термін.
Фактично хворі на низькозлоякісні НГЛ можуть не потребувати терапії багато років після постановки діагнозу. Однак пацієнтам, які мають В-симптоми або лімфоаденопатію чи цитопенію, що супроводжуються клінічними симптомами, часто призначаються паліативні променева та ХТ. Це часто призводить до клінічного покращення, але не підвищує виживаність хворих.
